Un cholestérol élevé est-il un facteur réel de risque cardiovasculaire ?
« Pour tout problème compliqué existe une solution simple, directe, compréhensible et erronée» HL Mencken
Il est exact que l’on retrouve du cholestérol dans les plaques d’athérome, mais celui ci ne représente que 10% de son contenu. On y retrouve surtout une prolifération de fibres et des fibroblastes qui les ont sécrétées, comme dans une cicatrice sclérotique, des globules blancs, des cellules musculaires lisses, des plaquettes, de la fibrine, du calcium et du fer, un puissant pro-oxydant et pro-inflammatoire… Tout ceci indique une réaction inflammatoire, impliquant les plaquettes (elles aussi activées par un processus inflammatoire).
Mais quelle est l’origine de ces épaississements ?
Lorsque l’on examine les artères d’un fœtus qui est mort in utero, on observe des épaississements, appelés « coussinets » aux bifurcations des grandes artères comme les carotides qui irriguent le cerveau. L’explication ? regardez par dessus un pont les remous de l’eau lorsqu’elle arrive sur une de ses piles. Face à une bifurcation l’écoulement du fluide est perturbé par l’obstacle, exerce des pressions et un stress sur le matériau du pilier. C’est exactement ce qui se passe dans l’artère. Le sang, au niveau de la bifurcation artérielle produit un stress dit « rhéologique » (dû à l’écoulement du fluide) et de ce fait la paroi artérielle s’adapte en s’épaississement. Cet épaississement chez le fœtus est évidemment considéré comme « physiologique » et pas comme athéromateux.
Pourquoi – c’est en écrasante majorité aux mêmes bifurcations des artères carotides, coronaires, rénales ou des membres inférieurs que se trouvent les plaques d’athérome de la personne plus âgée – les « coussinets », au départ souples et protecteurs, deviennent-ils rigides et dangereux ?
Pour le comprendre, il faut rappeler qu’il est vital pour nous de pouvoir arrêter toute hémorragie. En cas de blessure d’une artère le sang sous pression s’échappe à grande vitesse et la fuite peut entraîner le décès.
Afin d’enrayer cette fuite, les plaquettes s’activent dès que le revêtement de nos parois artérielles est endommagé. Elles se collent sur la lésion, recrutent d’autres plaquettes, sécrètent de puissants vasoconstricteurs qui vont resserrer l’artère comme la sérotonine et le paquet de plaquettes est ficelé par de la fibrine pour que le bouchon soit solide.
Le problème ? Est que cette activation des plaquettes est déclenchée par la moindre micro-lésion de la paroi artérielle.
Et aux bifurcations, les tourbillons provoquant des milliards de micro-stress, peuvent déclencher ce processus.
Et ceci, évidemment d’autant plus que d’autres facteurs d’aggravation s’ajoutent, en tête desquels, bien sûr, l’hypertension artérielle qui amplifie le stress rhéologique au point de pouvoir arracher des cellules de l’intérieur de la paroi, l’intima.
Mais bien d’autres facteurs favorisent des micro-lésions des parois artérielles et une tendance des plaquettes à sur-réagir :
le tabac et d’autres polluants, y compris atmosphériques
la sédentarité
le surpoids
le diabète
l’inflammation
l’excès d’oestrogènes ou d’androgènes
le déficits en de nombreux nutriments : oméga 3, antioxydants, magnésium, vitamines B…
un excès en oméga 6, en acide arachidonique, en fer, en cuivre…
Mais ne possède-t-on pas des défenses contre les bouchons plaquettaires ?
Nous sommes en effet capables de nettoyer, une fois l’alerte passée,les bouchons par un processus appelé la fibrinolyse.
Néanmoins le développement des bouchons provoque une inflammation de la paroi artérielle, une infiltration par des globules blancs agrémentés de restes de plaquettes et de fibrine dans lesquelles s’accumulent des minéraux systématiquement attirés par les régions enflammées comme le calcium et le fer et finit par laisser des « cicatrices », des plaques, de plus en plus épaisses.
Au passage, l’ail est un puissant fibrinolytique.
Mais nous n’avons toujours pas parlé du cholestérol, qui est pourtant bien là, même s’il ne l’est qu’en quantités faibles.
Que fait là le cholestérol ?
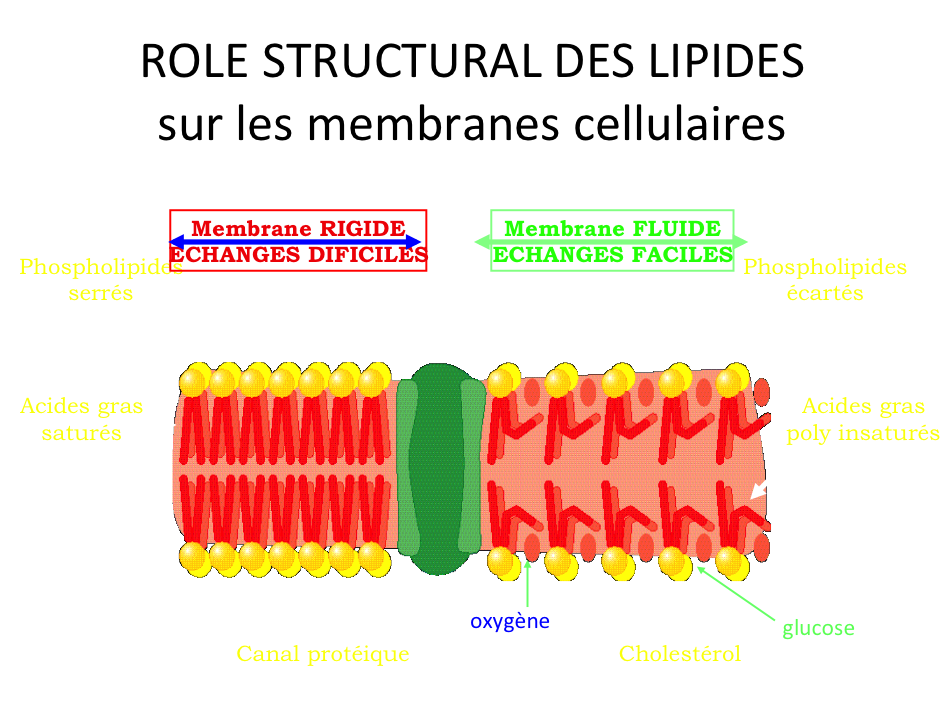
Nous l’avons vu, le cholestérol est vital pour toutes les cellules. C’est aussi le cas des cellules qui composent la paroi artérielle. Il passe donc du sang à l’intérieur des différentes régions de la paroi et ceci, sous la forme d’une boule sur laquelle est collée une étiquette, une protéine qui sert d’adresse postale, appelée Apo B. La boule de cholestérol avec son étiquette Apo B, c’est le cholestérol LDL.
La majeure partie de ce cholestérol est utilisée avec profit par les cellules qui forment l’artère.
S’il y a un excès de cholestérol qui passe dans l’artère, des cellules sont chargées de l’épurer, ce sont des globules blancs, cellules éboueuses qui nous débarrassent des poussières dans le poumon, des virus et des bactéries, mais aussi de beaucoup d’intrus indésirables : polluants, et même médicaments !
Pour ce faire, comme sur la membrane de la plupart des cellules, existe une protéine réceptrice capable de lire l’étiquette, le récepteur aux LDL, qui a une relation clé-serrure avec l’Apo B. Cette découverte a valu le Prix Nobel de Médecine à Joseph Goldstein et Michael Brown en 1985.
Cela permettait de comprendre pourquoi des personnes qui ont une mutation sur le gène codant pour le récepteur aux LDL, ayant des récepteurs moins efficaces ou en plus petit nombre, ont plus de cholestérol circulant dans le sang puisqu’il ne peut pas aussi bien être capté par les cellules.
L’industrie pharmaceutique et à leur suite les autorités de santé publique se sont appuyé sur ce travail pour pousser à la réduction du cholestérol alimentaire et à une promotion massive des statines.
Manque de chance, cette hypercholestérolémie, dite familiale est d’abord rare (seulement une personne sur 500 est concernée) des dépôts généralisés de cholestérol dans la peau, autour des yeux, dans les tendons… et de l’athérome seulement chez 50% d’entre eux… Autrement dit, 50% de ces personnes qui ont le cholestérol le plus élevé ne font pas de complications cardiovasculaires !
Par ailleurs quand on lit l’article original de Brown et Golsdstein, ils concluent en disant que les mutations génétiques déformant le récepteur aux LDL et réduisant l’adéquation clé-serrure et donc la captation du cholestérol sont rares et que cette adéquation pourrait être beaucoup plus communément compromise par l’altération de la protéine d’en face, l’étiquette Apo B, sans qu’il y ait mutation du récepteur.
Quelle extraordinaire intuition ! car les études postérieures vont leur donner raison.
Ils avaient en fait découvert dès 1979 que la vitesse à laquelle les macrophages captaient le cholestérol LDL ne pouvait pas expliquer l’accumulation de graisses. Ils avaient démontré que les LDL acétylées étaient captées de manière beaucoup plus significatives. Mais l’acétylation des LDL n’a pas été observée dans le corps humain.
Daniel Steinberg de l’Université de Californie à San Diego découvre que l’Apo B peut être facilement modifiée par accrochage de sucre ou oxydation. L’accrochage de sucre augmente le risque d’oxydation. Par ailleurs l’oxydation de graisses insaturées venant d’ailleurs (membranes cellulaires, plaquettes…) engendre un dérivé le MDA (malonedialdéhyde), augmenté par le tabac, la pollution, l’excès de fer, une alimentation pro-inflammatoire, la sédentarité, le surpoids, le diabète, l’hypertension, l’âge … – n’avons nous pas déjà vu cette liste quelque part ? – et que fait ce MDA ? Il se colle sur certains acides aminés de l’Apo B comme la lysine et compromet la relation clé-serrure avec le récepteur et la captation du cholestérol. Il y a donc de nombreuses raisons pour lesquelles le cholestérol LDL peut être modifié.
Revenons maintenant à notre paroi artérielle et à ses éboueurs, les macrophages.
Si l’Apo B n’est pas distordu, le macrophage va capter via le récepteur aux LDL l’excès de cholestérol, le détacher de son étiquette Apo B et coller une nouvelle étiquette Apo A1 et renvoyer le tout dans le courant sanguin. Cette nouvelle étiquette envoie le cholestérol vers la vésicule biliaire où il va être conjugué aux sels biliaires et excrété dans le tube digestif pour élimination. Plus il y aura de fibres dans le tube digestif, donc plus la personne consomme de végétaux, plus ce cholestérol sera effectivement éliminé via les selles. Dans le cas contraire, une partie plus ou moins importante peut être réabsorbée (ce qu’on appelle le cycle entéro-hépatique).
Comment appelle-t-on la boule de cholestérol avec l’étiquette Apo A1 ? Cholestérol HDL. C’est donc un cholestérol de retour, d’où sa réputation de « bon cholestérol » en contraste avec celle de « mauvais cholestérol » pour le LDL.
Mais ces adjectifs sont réductionnistes. Pourquoi ? parce que le cholestérol LDL est indispensable à toutes les cellules et qu’en cas d’excès les macrophages le renvoient se faire expulser via la vésicule biliaire. Et parce que le HDL peut être inefficace, par exemple en cas d’alimentation pauvre en végétaux.
Maintenant que se passe-t-il si c’est du LDL cholestérol modifié qui est dans la paroi artérielle ?
Le macrophage ne peut pas le « phagocyter » via le récepteur normal. Une équipe de Rockefeller University à New York montre qu’il est tout de même capté par un autre type de récepteur dit éboueur (« scavenger »).
Mais dans ce cas, pas possible de changer d’étiquette. Résultat : le cholestérol modifié reste dans les macrophages, les macrophages accumulent au fur et à mesure des années plus de cholestérol modifié.
Et on est en pleine cohérence avec les observations faites, de globules blancs gonflés de graisses, nommées cellules spumeuses.
Ces cellules spumeuses si elles gonflent trop, peuvent éclater. Avec l’apparition de ces stries graisseuses, les choses s’emballent. Le cholestérol modifié et les débris de macrophages éclatés attirent massivement d’autres éboueurs qui infiltrent la paroi. C’est l’explosion inflammatoire. Les cellules musculaires sur lesquelles on a aussi trouvé des récepteurs scavengers sont aussi stimulés et se multiplient, ainsi que les fibroblastes qui sécrètent des fibres.
Au total, les parois artérielles peuvent être endommagées en superficie au niveau de l’interface artère-sang par l’hypertension et les plaquettes et en profondeur non par le cholestérol… mais l’altération de son transporteur protéique, la modification de son « étiquette ».
Il faut ajouter qu’un simple épaississement des parois artérielles n’est pas capable de déclencher ni un infarctus, ni un AVC. Pour boucher complètement des artères il faut que s’ajoutent soit un bouchon plaquettaire, soit un spasme intense, soit les deux.
Et ni le bouchon plaquettaire, ni le spasme n’ont de rapport avec le cholestérol.
Premières conclusions :
Sont prioritaires :
la maîtrise de l’hypertension et de l’hyperactivité plaquettaire
la réduction de tous les facteurs de modification du cholestérol : surpoids, diabète, inflammation, oxydation, tabac, pollution…
Faire baisser le cholestérol n’empêche pas qu’il se modifie et qu’il ne devienne athérogène.
On comprend pourquoi le cholestérol HDL, qui est un marqueur d’un bon retour du cholestérol, est corrélé à une baisse du risque d’athérome et d’accident vasculaire.
Amarenco P et al, High-density lipoprotein-cholesterol and risk of stroke and carotid atherosclerosis : a systematic review, Atherosclerosis, 2008, 196 (2) : 489-96
Dans l’étude Health, Aging, and Body Composition Study sur des américains âgés de 70 à 79 ans, dont 385 d’entre eux avaient des antécédents coronariens, 1183 sujets à haut risque d’événements coronariens et 1535 étaient à faible risque.
Les participants ayant des antécédents de pathologie coronaire étaient plus volontiers des hommes fumeurs, et les sujets à haut risque avaient plus souvent une intolérance au glucose, un diabète, une hypercholestérolémie, une hypertension et un niveau circulant de protéine C-réactive élevé (la CRP, marqueur de l’inflammation est universellement reconnue maintenant comme un facteur de risque cardiovasculaire).
Après ajustement sur les facteurs de risque tel que le tabac, le cholestérol LDL, la protéine C-réactive, l’âge et le sexe, le risque de pathologie coronarienne pour les sujets présentant le niveau le plus élevé de LDL oxydés (les lipoprotéines qui transportent le cholestérol et dont la protéine-étiquette ApoB a été altérée par oxydation) est multiplié par 2,79.
L’élévation de la protéine C-réactive (CRP) est corrélée à celle des LDL oxydées confirmant ainsi le rôle central de l’inflammation dans le processus athérogène.
Les auteurs concluent que la puissance prédictive des LDL oxydées est beaucoup plus importante, que celle du cholestérol LDL.
Holvoet P et al, Association of high coronary heart disease risk status with circulating oxidized LDL in the well-functioning elderly : findings from the Health, Aging, and Body Composition study, Arterioscler Thromb Vasc Biol, 2003, 23 (8) : 1444-8
Dans la même cohorte, un LDL cholestérol oxydé élevé augmente de 30 à 55% le risque de rigidité artérielle, indépendamment de tout facteur de risque cardiovasculaire.
Tina E. Brinkley et al, Plasma Oxidized Low-density Lipoprotein Levels and Arterial Stiffness in Older Adults : the Health ABC Study, Hypertension, 2009, 53 (5) : 846–852.
La simple pollution aérienne élève les LDL oxydées.
Lotte Jacobs et al, Traffic Air Pollution and Oxidized LDL, PLoS One, 2011, 6 (1) : e16200
Alors quelle protection pour les consommateurs de statines qui respirent un air supplémenté en particules de diesel, qui restent sédentaires ou en surpoids ou qui continuent à consommer une alimentation massivement pro-inflammatoire (trop de viandes, pas assez de végétaux, café plutôt que thé….) ?
Il faut être de mauvaise foi aujourd’hui pour ne pas reconnaître ces faits.
Mais les reconnaître implique de massifs changements de pratique médicale et de santé publique.






0 commentaires